7 min read
2022-Cell-Gut bacterial nutrient preferences quantified in vivo
2022-09-04
Gut bacterial nutrient preferences quantified in vivo
为什么读这篇文章
- 利用stable isotope tracing来进行定量分析菌群营养偏好的文章,利用stable isotope tracing这个idea是一直很感兴趣的点
相关链接
BioArt
Background
- 菌群生长的营养来源于肠道摄入,可以是摄入的食物,宿主合成的肠道粘液,宿主的循环代谢物。
- 肠道微生物群对营养素的可用性取决于其吸收程度,小肠中吸收的物质,比如淀粉,则不会被结直肠微生物利用。相反,在上消化道消化不良的营养物质(比如纤维)则可能是关键的微生物组原料
- 之前的研究主要是结合质谱和同位素标记针对特定的microbe来确定其代谢输入(基于每个菌株specific的peptide sequences)
- 这篇文章最主要的点是进行了一个大规模,定量的评估肠道菌群的代谢输入和产物
- 输入:食物淀粉dietary starch, 纤维fiber, 蛋白, 宿主粘液host mucus
- 还有常见的循环代谢物有三种,lactate, 3-hydroxybutrate, urea从宿主进入到microbiome作为营养
- 然后通过分析bacteria-specific peptide sequences,能够评估每个菌属的营养偏好,并表明这种营养偏好使菌群组成和饮食改变一致。
Microbiome consumes less digestible dietary components
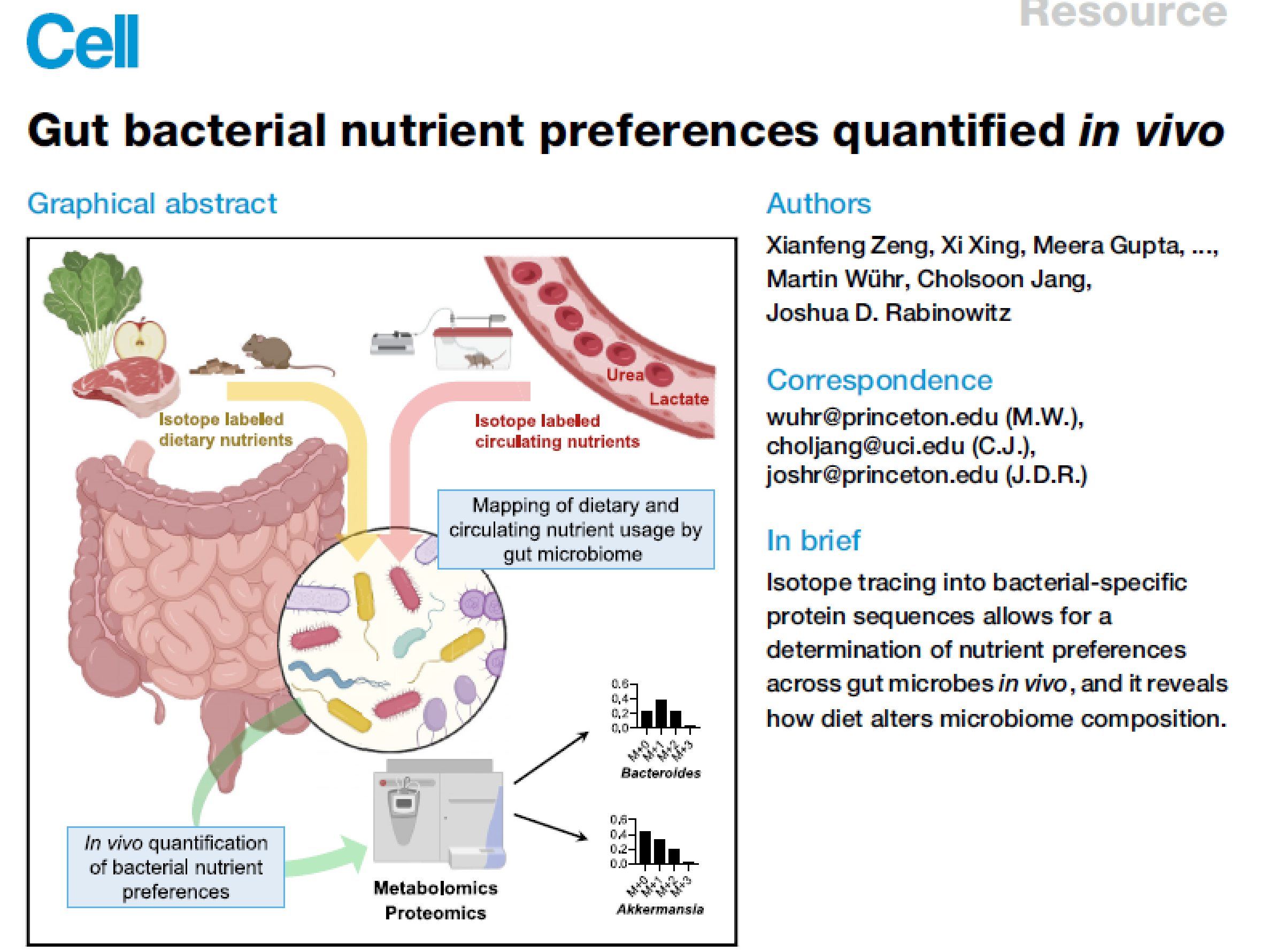
- 这篇文章的分析的代谢物主要是50多种肠道微生物,注意所有这些微生物都进行了绝对定量(SCFA最高,0.4-2 mM; 然后是一些芳香族氨基酸的发酵产物,比如phenol, indoxyl sulfate, 3-phenylpropionate,和支链氨基酸;然后是初级胆汁酸 ~10 uM,最后次级胆汁酸 3uM)
- 作者进一步用口服同位素标记实验(oral gavage)来研究分析这些microbiota代谢物的营养来源,包括淀粉starch (易被消化的葡萄糖前体),inulin (菊粉,不易被消化的果糖前体)。分别检测Portal blood以及cecal content。显然starch会很快造成glucose, lactate, and alanine被标记,占口服carbon的~75%。而inulin则不会标记上这些,但其标记上的SCFA的时间要明显要更长,占标记的~40%,剩余的则被粪便排除。比较有意思的一个点是在粪便中还检测到了labeled glycolytic 和TCA的中间产物和氨基酸
- 类似的,也进行了口服13C标记的free AA mixture和海藻蛋白mixture。和前面结果类似,AA会导致portal AA的快速升高,而protein则会导致菌群代谢物升高
- 第一部分主要证明了难以被消化的carbohydrates和protein,而host是间接参与到microbiota products
- 第二个部分,作者去看是否存在可能性,即宿主的循环代谢物feed肠道微生物。infuse(通过导管)了氘水和18种主要的循环代谢物。
- D20是完全交换了的,其他除了lactate和3-hydroxybutyrate外,其他circulating metabolites并没有渗入到feces中。Lactate和3-hydroxybutyrate是因为MCT的底物,并且高表达在结肠中。
- 这部分结果证明的是只有少数的circulating metabolites进入到了microbiome
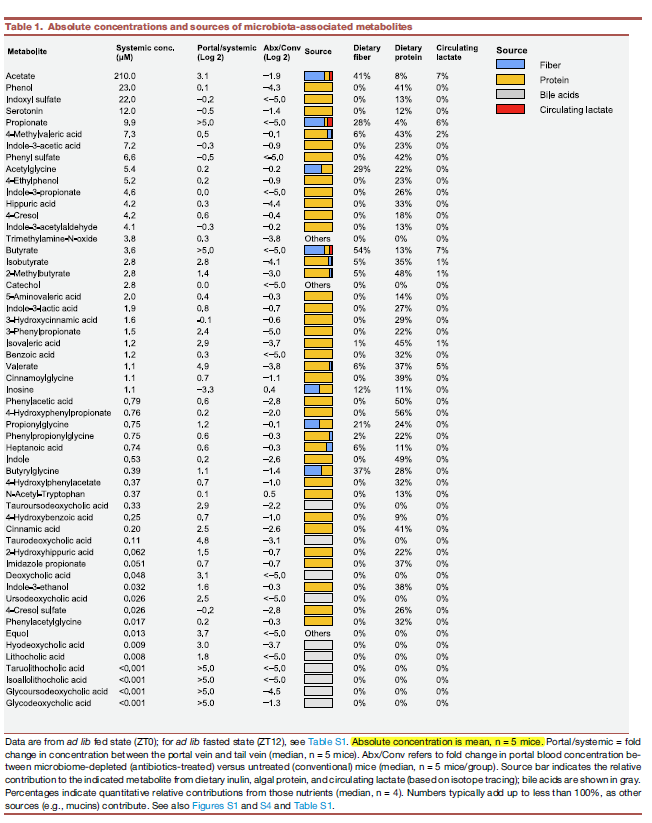
Circulating urea is a microbiome nitrogen source
- 第三部分,寻找N源。注射了12种高含量的含15N标记的代谢物。只有urea和ammonia进入到了粪便的microbiome,而不是氨基酸。
- ammonia是先转化成为urea然后进入microbiome
Microbiota synthesize amino acids from fiber and urea
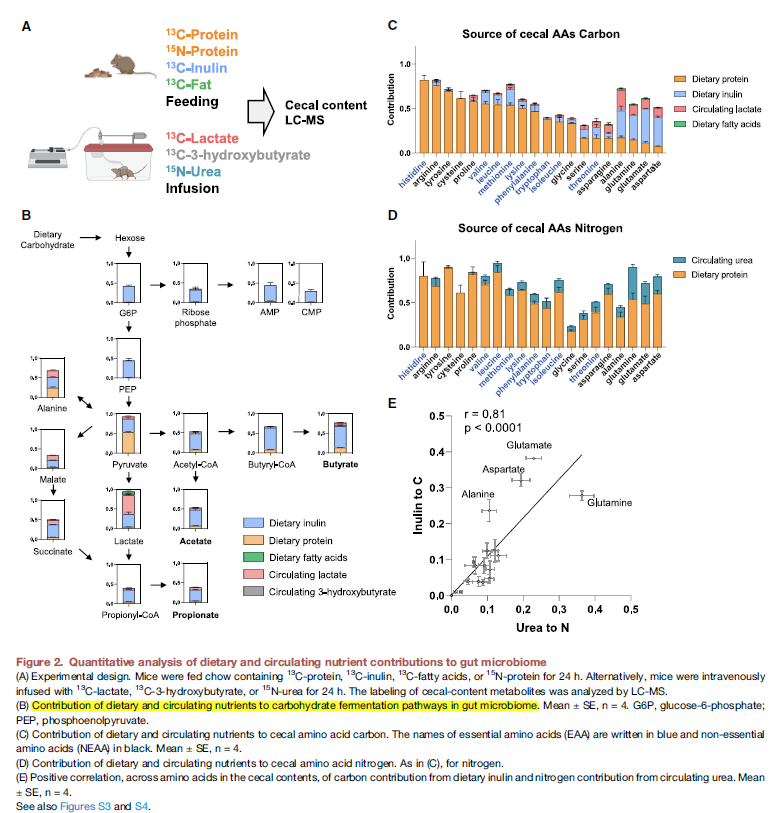
- 为了更进一步的量化的评估microbiome metabolite sources, 分别用13C, 15N的protein,13C的inulin,13C-Fat来喂养,13C lactate, 13C-3-hydroxybutyrate, 15N-urea来注射,这些基本上涵盖了大部分microbiota-derived代谢物的C源。
- Glycolytic和pentose phosphate主要来自于dietary fiber (inulin), pyrutate和TCA代谢物主要来自于dietary protein和circulating lactate.
- 下一步验证microbiome free amino acids的营养输入,使用15-N labeled protein和infused urea. 这里,与mammals不同,大部分bacteria有生物合成所有20个proteogenic amino acid的途径。必须氨基酸的C源主要来自于protein,而非必须氨基酸的C源主要是inulin以及循环的lactate。
- 同时,dietary protein也是必要和非必要氨基酸的主要N源,而urea则贡献更多在非必要氨基酸上。
Diverse microbiome products come from dietary protein
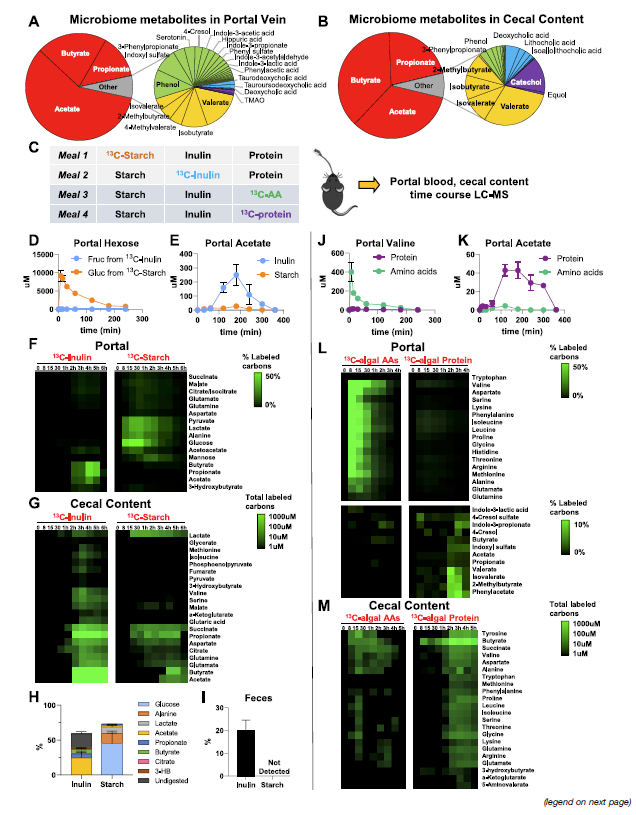
- 再看完氨基酸的合成来源后再进一步去看其他MDM,即前面绝对定量的那些代谢物。主要SCFA 来源于食物纤维(此处为菊粉),其他代谢物主要来自食物蛋白 (table 1)
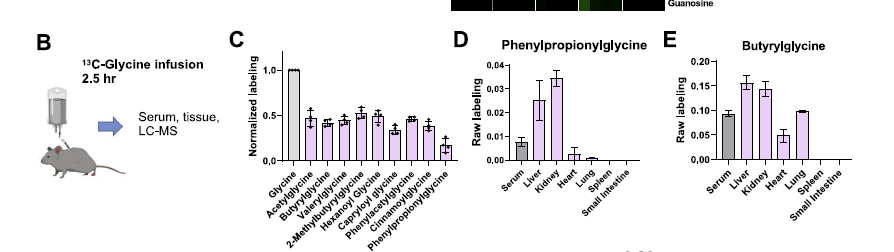
- 这边有意思的一个点是,除了比较经典的MDM,还能够观察一些从MDM进一步和宿主衍生合成出来的化合物,比如很多的glycine和一些有机酸的conjungation
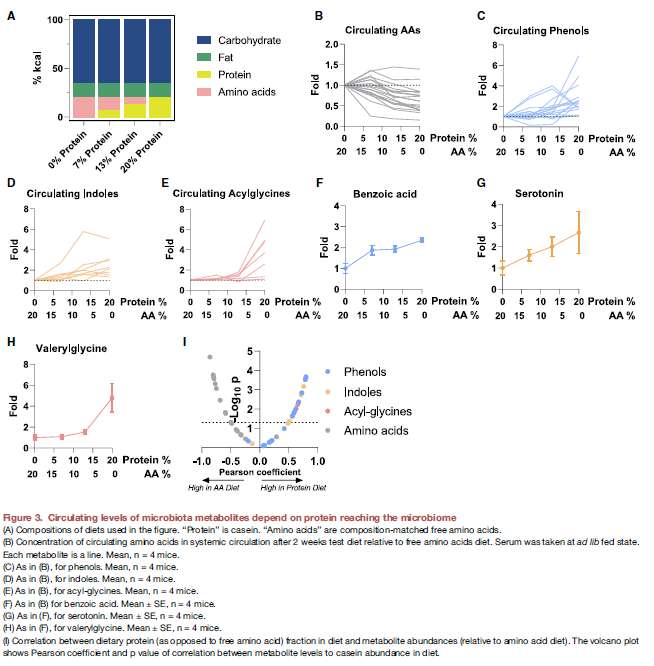
- 由于他们观察到这些MDM大部分是来源于到达colon中没有被吸收的食物蛋白,那么他们就进一步假设这些circulating代谢物的水平是不是depend on the extent of dietary protein.
- 作者改变了小鼠的饮食组成,即在四组中用不同比例的protein和AA composition. 然后分析小鼠的血液。
- 结果:对于AA,protein越少,循环系统中的AA就越高(Negative control),而MDM则对应的越少
- 这些其实证明了通过了解nutrient source来源可以改变MDM的系统水平
Gut bacterial growth is synchronized with host feeding
- 前面主要是将gut microbiome作为一个整体来研究输入和输出,然后作者shift到特定的菌属下面
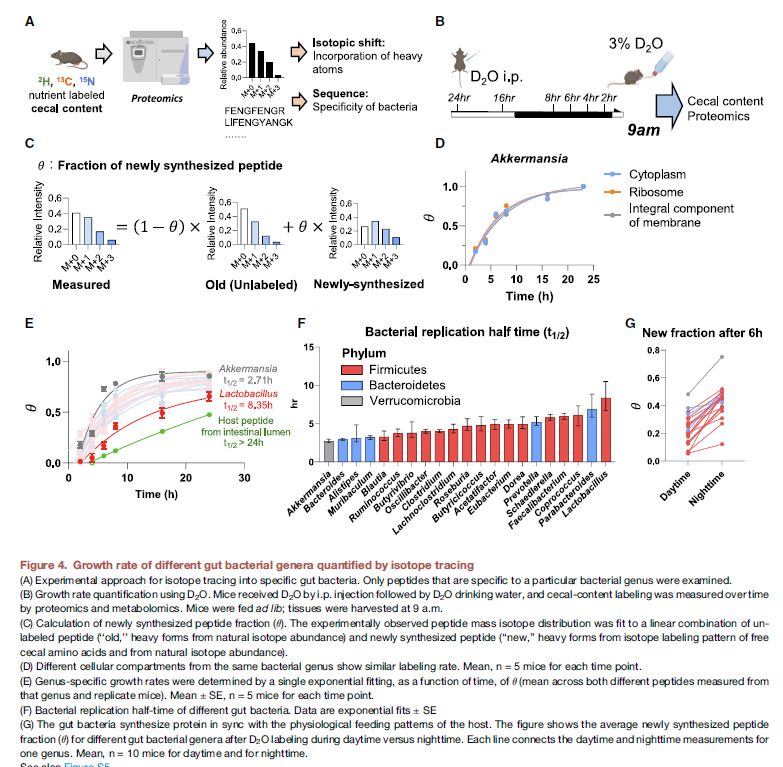
- 利用D2O进行tracing,然后对菌群特异性的peptide进行分析,计算出新合成的peptide percentage。具体的分析要好好看一下, 这个分析好像和高扬里面涉及的会比较像 大概原理,利用unlabel样本计算old MID, 利用合成氨基酸来源的同位素标记计算理论的新合成的MID,通过实验测得的MID算是fraction
- 这个fraction可以用来表征生长速率,先用一个单一的菌株来验证了一下这个方法,证明与OD600有很好的一致性
- 然后分析利用特定的peptide来研究不同菌群利用这些bacteria的half douling time,结论证明不同的菌属合成速率不同,Akkermansia最短 ~2.5h,Lactobacilus大概8h,而宿主的pepitide则要超过24h
- 有意思的一个数据,晚上的fraction要高于白天
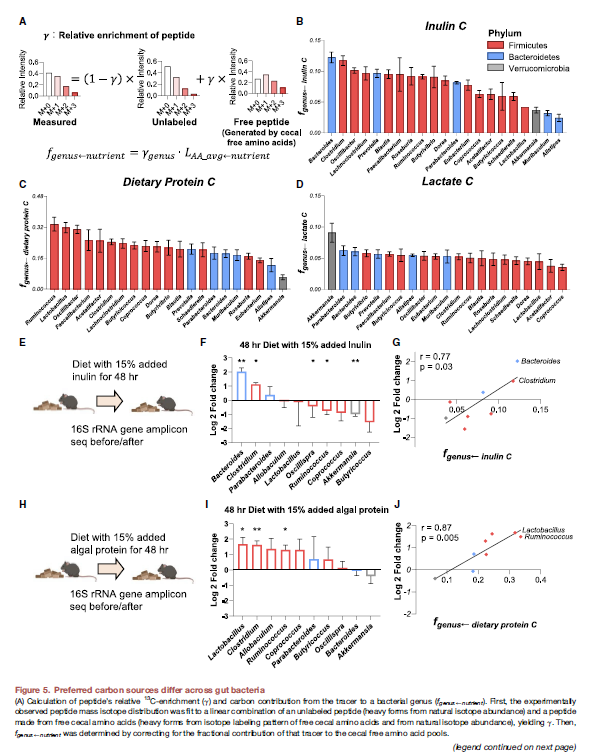
Preferred carbon sources differ across gut bacteria
- 然后进一步去看不同种属对不同碳源的影响,即之前研究过3个C源的dietary inulin, dietary algal protein, circulaing lactate
- 具体到每个tracer下面,这个γ的计算和上面是类似的,然后乘以每个tracer对amino acid pool的contribution,从而算到tracer对这个peptide的genus的contribution
- 然后观察到不同microbiota对于nutrient preferences。比如Bacteroids和Clostridium比Akkermansia等多4fold的inulin利用;Protein C, Firmicute > Bacteroidetes; Akkermansia利用了更多的Lactates
- 然后作者进一步验证了下这种bacterial nutrient preferences能否预测microbiome的composition change. 利用16S进行了验证
Firmicutes consume dietary protein, while Bacteroidetes consume secreted host protein
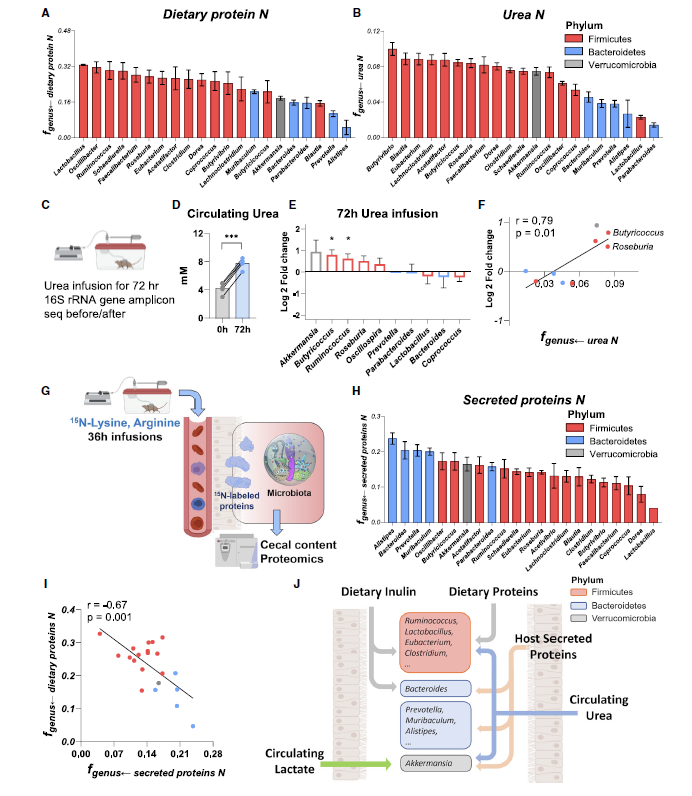
- 类似的,对不同菌属对于N源的摄取偏好进行分析,利用15N全标的蛋白。
- 结论:
- 从protein摄取C源的bacteria也从protein摄取N源
- 倾向从Urea获取N源的菌属喜欢从inulin获取C源,利用infusion Urea进行了16S验证
- 而对于bacteroidetes,既不从protein也不从urea获取N源,那么N从哪里来呢。证明这个点是来自于与宿主分泌的粘液
感受
- 逻辑:先确定哪些nutrient contribute到了microbiome,然后分别确定共享的比例,包括氨基酸和其他MDM,然后证明改变nutrient能够调节循环系统中MDM的水平,然后在菌属水平分析不同菌属对于C源和N源的摄入偏好是不一样的
- 哪些营养物质给肠道菌贡献了营养,从一些常见的代谢物出发。而绝对定量对于整合每个来源的贡献是最重要的,不然相对定量则没法计算
- 还有意思的几个问题:
- 文章主要是盯着50个左右的MDM,没有回答的问题是这些营养物质给多少肠道微生物贡献了营养
- 同时,反过来,肠道微生物又给循环系统贡献了多少代谢物
- 是什么原因造成了这些菌属的饮食偏好,文章中提到了点可能是位置的原因,那么从基因和酶的层面又是怎么样的呢









