
A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites
为什么读这篇文章:
- Dylan Dodd在Justin Sunnenburg组的文章,利用这篇文章找到的教职
- 这篇文章和之前读的Annu Review有比较紧密的关联
background
- 人类肠道微生物产生了很多循环代谢物,并且有比较高的浓度(10uM-1mM), 但是对于产生的代谢pathway的了解还非常有限。建立微生物代谢与宿主健康的主要挑战:
- 去表征这些代谢物的生物学活性以及与疾病的关联
- 鉴定生成这些代谢物的pathway,使从基因组预测代谢产出成为可能
- 使用遗传手段和合成ecology来重新编程菌群的代谢产出
- 本篇文章的主要目标是鉴定C. sporogenes (厚壁菌门Firmicutes)的indolepropionic acid (IPA)的产生途径
- IPA是已知微生物从食物的tryptophan转变而来,进而在serum中累积的一类代谢物,近期已有研究表明其可以通过结合PXR受体(pregnane X receptor)来增强肠道屏障(intestinal barrier)。但是其微生物产生途径还不清楚。
- 已有的研究发现一小部分bacteria,比如C. sporogenes,C. sporogenes等可以从tryptophan生成IPA。同时这些菌还能将phe(丙苯氨酸)和thr(酪氨酸)生成对应的丙氨酸形式,phenylpropionic acid (PPA) and 4-hydroxyphenylpropionic (4-OH-PPA)。
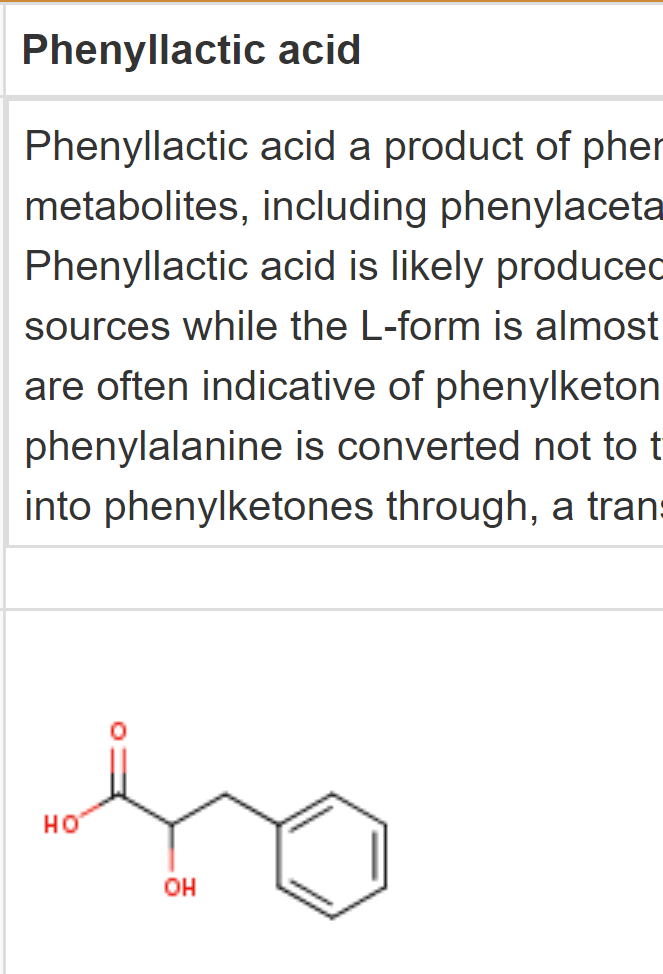
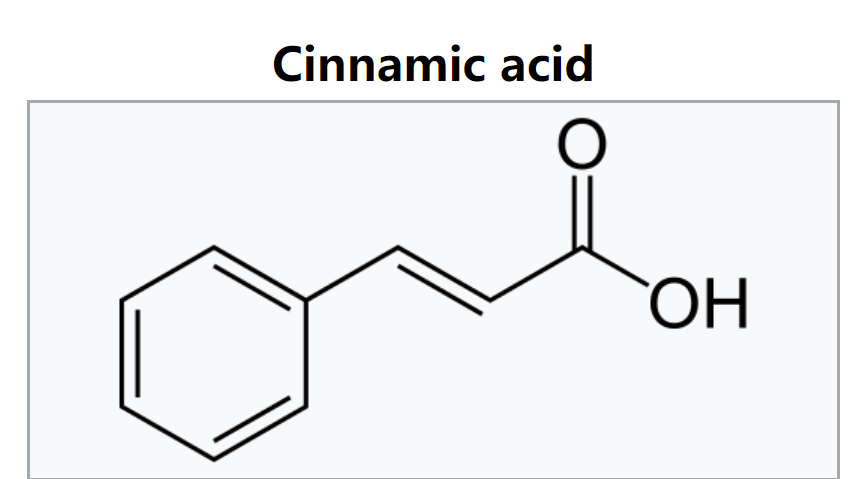
- 其中phe的代谢已经被研究过,主要的酶已经被纯化出来了,其中最主要的能量消耗步骤是 phenyllactic acid -> t-cinnamic acid的脱水反应dehydration,通过phenyllactate dehydratase (FldABC)
Result
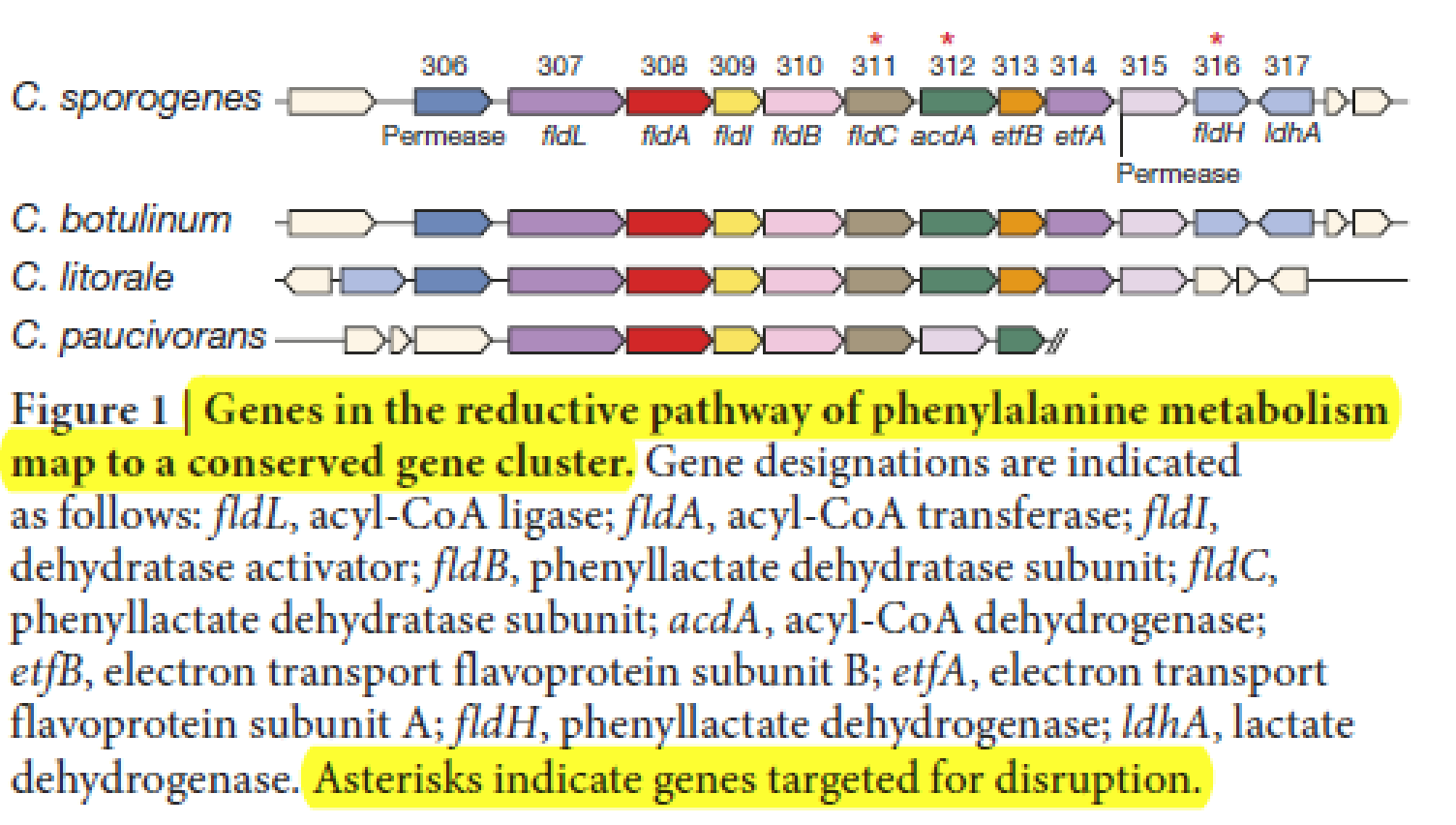
- 初步的假设,IPA可能也是通过和PPA相似的途径,需要相似的同工酶(paralogous dehydratase),但是作者通过分析C. sporogenes. 并没有发现接近的related dehydratase,因此作者怀疑是不是phenyllactate dehydratase本身也参与到了IPA的production
- 作者选择了fldC进行mutation,为了研究这种mutation的影响,在m包含10 essential amino acid的培养基中minimal medium培养 WT和mutation 细菌株。相比于mutation组,WT组显示出明显更快的生长速率(Fig2a), 且在glocuse培养基中则没有明显区别(Fig2b)。
- 同时丙酸形式的产物PPA, 4-OH-PPA以及IPA均明显降低(Fig2c)。从而表明fldA对于还原反应的进行是必要的,从而为这个shared 还原通路提供了基础
- 为了评估 fldC 突变体中的代谢阻断,制备了细胞悬液,其中来自生长培养基的氨基酸被洗掉。然后将wild-type和mutant菌株用细胞悬液培养,并加入不同的aromatic amino acid. 然后用LC-MS/MS评价还原通路和氧化通路的最终产物。可以看到明显的PPA,4-OH-PPA以及IPA产物,而mutatant则没有(Fig2d)。
- 在依次加入中间产物评估的时候证明fldC是催化丙乙烯酸到丙酸的酶(Fig2e)
- 上述结果共同证明fldC是生物合成IPA,4OH-PPA以及PPA所必须的,并且证明phenyllactate dehydratase是还原反应的倒数第二步酶。
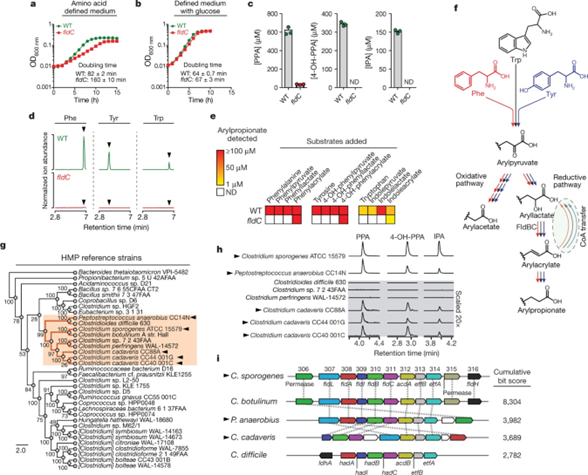
- 已知的产生IPA的菌只有C. sporogenes,通过发现这个菌生成IPA的基因,那么share这些基因片段的菌株是否也有生成IPA的能力。基于RpoB蛋白序列分析,利用phylogenetic analysis发现8个family。
- 测试了40个strains在reinforced clostridial medium (RCM) 培养基中培养,36个能够生长的菌株中有31个没有测到arylpropionate levels. 但是除了C. sporogenes(Fig.2h),还发现了额外4株具备合成丙酸的能力,同时这些菌株有与C. sporogenes相比有完全不一样的遗传发育背景。
- 进一步发现这些菌执行功能是通过相似的gene cluster (Fig.2i)
- 这些结果证明gut bacteria生成IPA比之前相的要普遍的多,并且是通过相似的BGC执行功能
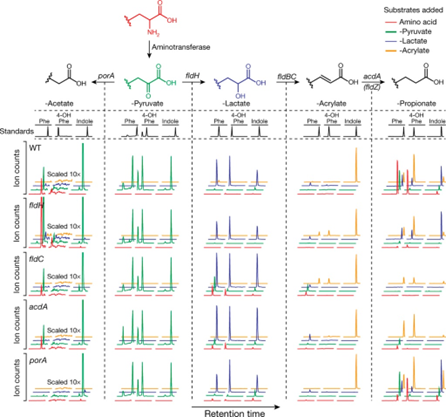 要理解这个图,要明白其实每一列提的EIC均是上面的propose的代谢中间产物
要理解这个图,要明白其实每一列提的EIC均是上面的propose的代谢中间产物
- 为了进一步研究AAA通路,作者构建了4个外的突变株,porA, fldH, acdA, fldZ,这些可能在oxidative或者reductive AAA代谢中发挥作用。
- 与野生型相比,fldH、fldC 和 acdA 突变体缺乏苯丙氨酸、酪氨酸和色氨酸的还原代谢(第 1-4 行,第 5 列,红色和绿色迹线)。
- 相对于野生型,porA突变体缺乏苯丙氨酸和酪氨酸的氧化代谢,但不存在色氨酸(第 1 行和第 5 行,第 1 列,红色和绿色痕迹)。
- fldZ不涉及还原性的AAA代谢
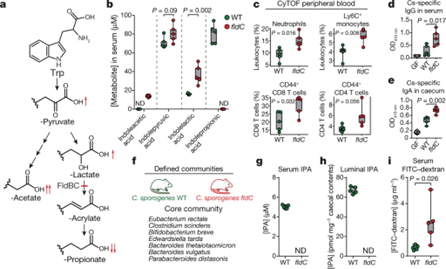
- 这些突变是否可以通过移植来宿主中调节circulating metabolites的含量。这里使用了tryotopan-derived metabolites,主要是因为他们是已知microbiota-depended的方式可以再serum中进行累积
- 确实发现在fldC突变株中,IPA的含量明显下调,而前体indole-lactate, pyruviate出现上调。证明在实验动物model中,遗传操作可以改变3个高浓度的菌群代谢物浓度(Fig4b)
- 已知的研究表明IPA可以通过结合PXR受体,降低intestinal permeability(肠道璧的通透性),提升肠道壁垒屏障。而肠道壁垒作用的降低则会伴随mucosal immune的激活。即IPA升高,通透性降低,肠道壁垒升高,免疫水平降低
- 发现确实mutant菌株中,免疫细胞有明显的增加(Fig4c),免疫球蛋白lgG(Fig4d),lgA蛋白增加(Fig4e)
- 最后探究了这种遗传操作是否在更复杂的菌群群落中也稳定,然后发现结果也都是一致的(Fig4g, Fig4h, Fig4i)
总结
- 这篇文章证明了C. sporogenes reductive AAA pathway能够产生12个代谢物,其中9个是已知累积在宿主代谢,至少有3个是microbiota特有的
- 这篇文章为遗传操作可以调节菌群,进而调节高丰度的菌群代谢物提供了直接的证据,并能影响宿主的physiology